Avances para tratar el cáncer provocado por factores externos por el Dr. Juan Carlos Izpisua
La investigación, financiada por la UCAM, se centra en la modificación de las marcas que provocan el desarrollo de cáncer de estómago, colon o riñón, o trastornos neurodegenerativos raros como el Síndrome de Angelman. La prestigiosa publicación científica da a conocer a nivel mundial la nueva técnica de edición génica del equipo del Dr. Izpisua, que permite reparar estos trastornos epigenéticos aberrantes.
Un grupo de científicos liderados por el Dr. Juan Carlos Izpisua han desarrollado una nueva técnica que permite modificar, de manera controlada y dirigida, las marcas del ADN que afectan a la expresión de los genes y que provocan enfermedades graves. Este tipo de marcas, que pueden estar provocadas por factores externos como la alimentación, el tabaco, el estrés, etc., constituyen lo que denominamos epigenética o epigenoma, y juegan un papel tan importante como los propios genes en el desarrollo de cada individuo y en aparición de enfermedades.
La nueva técnica va más allá de los genes, modifica el tipo más común de marca epigenética, conocida como “metilación del ADN”, en la que se unen al ADN marcas químicas llamadas grupos metilo. Estas marcas contribuyen a la regulación de la expresión génica, de forma que aquellos genes “metilados” se consideran “apagados”. Estudios previos habían logrado alterar el estado de metilación en secuencias de ADN cortas, pero hasta ahora nadie había sido capaz de crear y mantener estas marcas epigenéticas a largo plazo en grandes regiones del genoma (un requisito para el proceso de desactivación génica). Cada vez más, se sabe que la metilación del ADN está involucrada en una serie de procesos fisiológicos y patológicos que van desde el desarrollo embrionario hasta el inicio de ciertas enfermedades como el cáncer.
Esta nueva técnica, es publicada por la revista Science, y en ella se describe como su uso en células pluripotentes permite, por una parte, crear modelos de alteraciones epigenéticas relacionados con diversas enfermedades, como el cáncer de colon, y por otra, restaurar los patrones de metilación de pacientes con enfermedades como el Síndrome de Angelman (AS), un trastorno neurodegenerativo raro que, a menudo, es diagnosticado como autismo. Además de modelar y tratar trastornos epigenéticos, esta tecnología abre nuevas vías para el estudio del desarrollo humano y la biología en general.
"Estamos entusiasmados con las nuevas vías de trabajo que abre este estudio para entender los procesos asociados a enfermedades y desarrollar nuevas terapias efectivas", dice el Dr. Izpisua Belmonte, autor principal del documento y titular de la Cátedra Roger Guillemin del Salk Institute y de la Cátedra de Biología del Desarrollo de la Universidad Católica de Murcia (UCAM).
"Esta tecnología para editar el epigenoma es un paso importante, al igual que lo fue, en su momento, descubrir cómo editar el genoma."
Dr. Izpisua Belmonte
El 80% del ADN de los mamíferos está metilado y se sabe que en el 20% restante, libre de metilación, existen áreas denominadas “islas CpG”, que son paradójicamente regiones ricas en posibles sitios de metilación que tienden a estar cerca de regiones donde comienza la transcripción de información genética, por lo que la presencia o ausencia de metilación en la misma es responsable de la expresión de un gen concreto. El grupo liderado por el Dr. Izpisua no quiso desaprovechar la oportunidad de emplear nuevas técnicas de edición génica mediante el sistema de CRISPR-Cas9 para tratar de modificar el estado de metilación de estas regiones y decidieron interferir en la secuencia de las “islas CpG” para intentar desencadenar procesos de nueva metilación.
Para ello, insertaron un pequeño fragmento de ADN libre de CpGs en la isla localizada cerca del gen MLH1, que normalmente no está metilado, pero cuando se metila, lleva a un mayor riesgo para desarrollar cáncer de colon. Los resultados de este cambio, fueron la metilación de la isla asociada con el gen MLH1, tal y como ocurre en el cáncer de colon. Esta prueba de concepto permitirá estudiar con profundidad la función de esta metilación anormal en el desarrollo del cáncer.
"Lo interesante de las islas CpG es que se resisten a la metilación. Pero al introducir el ADN libre de CpG, podemos anular la maquinaria que lo bloquea, induciendo así la metilación del ADN de toda la isla."
Dr. Yuta Takahashi
Una vez puesta a punto la técnica para metilar zonas que, en principio no deben estarlo, el equipo investigador trató de llevar a cabo esta inducción en islas CpG que se encuentran no metiladas en situaciones patológicas, pero que deberían estarlo. El síndrome de Angelman (AS) es el resultado de un patrón de metilación aberrante del ADN, que causa la pérdida de la proteína UBE3A en las neuronas y provoca un déficit cognitivo en los pacientes. Mediante el uso de esta técnica, pudieron corregir la metilación anormal del ADN y restaurar los niveles de la proteína UBE3A en células neuronales AS.
Lo más importante, según los investigadores, es el hecho de que todos los patrones de metilación inducidos con esta técnica, fueron estables a lo largo del tiempo, lo que no se ha podido conseguir, hasta ahora, con otras técnicas epigenéticas. Este resultado permite reescribir marcas epigenéticas en las islas CpG, así como estudiar el mecanismo por el cual estas islas están protegidas frente a la metilación.
"Es muy importante haber desarrollado una nueva técnica que permita la edición controlada y estable del ADN en las islas CpG de células pluripotentes, porque ayudará a desarrollar terapias celulares alternativas para los trastornos epigenéticos. Pero esta técnica es mucho más importante, ya que permite estudiar los mecanismos responsables del patrón de metilación del ADN.”
Dr. Jun Wu
Este trabajo ha sido financiado por: NIH–National Cancer Institute (NCI), Chapman Foundation, Leona M. and Harry B. Helmsley Charitable Trust, Universidad Católica de Murcia (UCAM) y G. Harold and Leila Y. Mathers Charitable Foundation.
Autores del trabajo: Yuta Takahashi, Jun Wu, Keiichiro Suzuki, Paloma Martínez Redondo, Mo Li, Hsin-Kai Liao, Min-Zu Wu, Reyna Hernández-Benítez, Tomoaki Hishida, Maxim Nikolaievich Shokhirev, Concepción Rodríguez Esteban, Ignacio Sancho-Martínez and Juan Carlos Izpisua Belmonte.
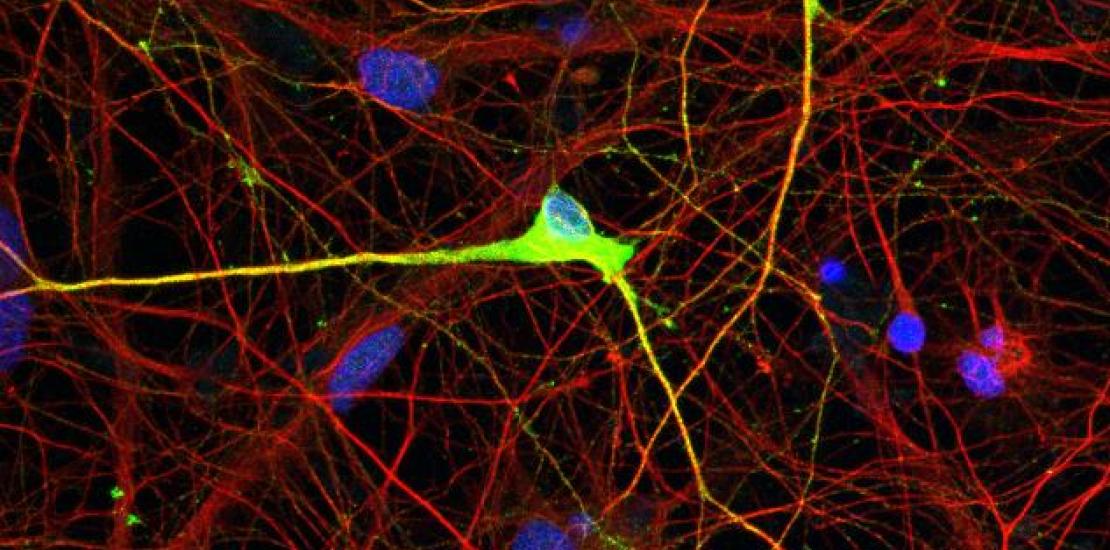
Neuronas de pacientes con síndrome de Angelman (AS) que carecen de expresión de la proteína UBE3A debido a un defecto epigenético. La nueva técnica es capaz de restaurar la expresión de la proteína UBE3A en neuronas derivadas de células pluripotentes de estos pacientes a través de la corrección epigenética de las mismas.
Esquema de edición epigenética mediante la integración de un pequeño fragmento de ADN sin islas CpG. Arriba: los círculos abiertos indican la falta de metilación en el estado patológico. Abajo: Los círculos negros indican la metilación apropiada inducida por la inserción precisa de un pequeño fragmento de ADN no metilado en una isla CpG.